Ферменты – биологические катализаторы. Значение ферментов
Ферменты – биологические катализаторы. Значение ферментов
Комментарии преподавателя
Ферменты – это белковые молекулы, которые синтезируются живыми клетками. В каждой клетке насчитывается более сотни различных ферментов. Роль ферментов в клетке колоссальна. С их помощью химические реакции идут с высокой скоростью, при температуре, подходящей для данного организма.
То есть ферменты – это биологические катализаторы, которые облегчают протекание химической реакции и за счет этого увеличивают её скорость. Как катализаторы они не изменяют направление реакции и не расходуются в процессе реакции.
Ферменты-биокатализаторы – вещества, увеличивающие скорость химических реакций.
Без ферментов все реакции в живых организмах протекали бы очень медленно и не могли бы поддерживать его жизнеспособность.
Наглядный пример работы ферментов – сладковатый вкус во рту, который появляется при пережевывании продуктов, содержащих крахмал (например, риса или картофеля). Появление сладкого вкуса связано с работой фермента амилазы, которая присутствует в слюне и расщепляет крахмал. Крахмал является полисахаридом, и сам по себе безвкусный, но продукты расщепления крахмала (моносахариды) с меньшей молекулярной массой (декстрины, мальтоза, глюкоза) сладкие на вкус.

Механизм действия амилазы - sosudinfo.ru
Все ферменты – глобулярные белки с третичной или четвертичной структурой. Ферменты могут быть простыми, состоящими только из белка, и сложными.
Сложные ферменты состоят из белковой и небелковой части (белковая часть – апофермент, а добавочная небелковая – кофермент). В качестве кофермента могут выступать витамины – E, K, B групп

twlwsixt.appspot.com- Классификация ферментов по их составу
Фермент взаимодействует с субстратом, не всей молекулой, а отдельной её частью – т. н. активным центром.
Фермент взаимодействует с субстратом и образует короткоживущий фермент-субстратный комплекс. По завершении реакции, фермент-субстратный комплекс распадается на продукты и фермент. Фермент в итоге не изменяется: по окончании реакции он остается таким же, каким был до неё, и может теперь взаимодействовать с новой молекулой субстрата
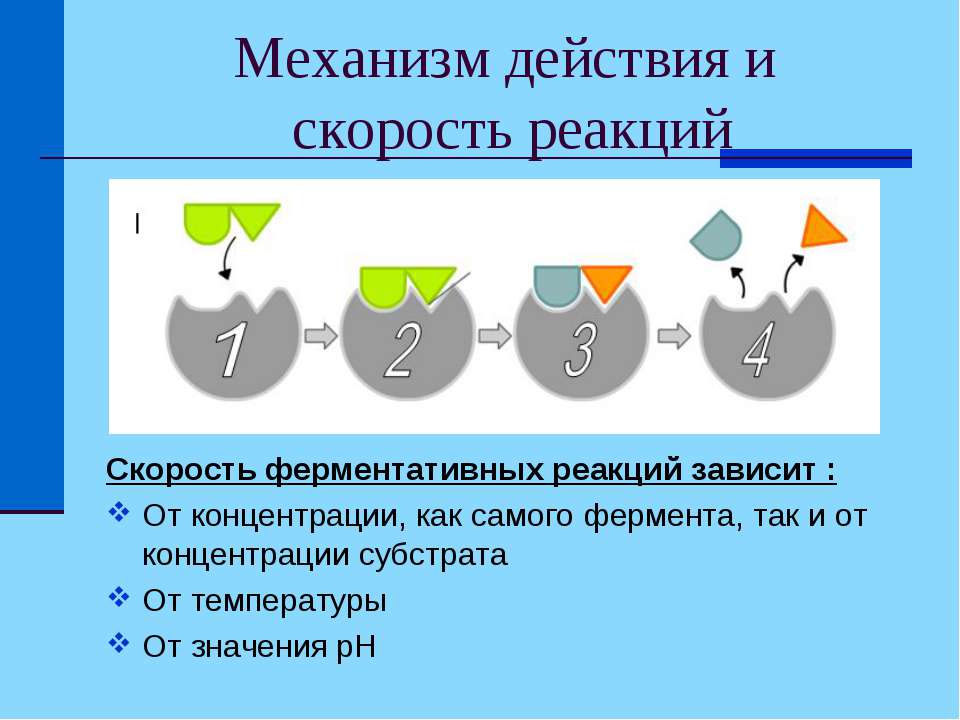
uslide.ru - Механизм взаимодействия фермента и субстрата
На рисунке представлен механизм работы фермента, в частности, образования пептидной связи между молекулами аминокислот. Две аминокислоты взаимодействуют между собой в активном центре фермента, между ними образуется пептидная связь. Новое вещество (дипептид) покидает активный центр фермента, поскольку оно по своей структуре не соответствует этому центру.
Особенностью ферментов является то, что они обладают высокой специфичностью, т. е. могут ускорять только одну реакцию или реакции одного типа.
В 1890 году Э. Г. Фишер предположил, что эта специфичность обусловлена особой формой молекулы фермента, которая точно соответствует форме молекулы субстрата. Эта гипотеза получила название «ключа и замка», где ключ сравнивается с субстратом, а замок – с ферментом. Гипотеза гласит: субстрат подходит к ферменту, как ключ подходит к замку. Избирательность действия фермента связана со строением его активного центра


studfiles.ru - Гипотеза взаимодействия фермента и субстрата по принципу ключ-замок Э. Г. Фишера
В первую очередь, на активность фермента влияет температура. С повышением температуры скорость химической реакции возрастает. Увеличивается скорость молекул, у них появляется больше шансов столкнуться друг с другом. Следовательно, увеличивается вероятность того, что реакция между ними произойдет. Температура, обеспечивающая наибольшую активность фермента – оптимальная.
За пределами оптимальной температуры скорость реакции снижается вследствие денатурации белков. Когда температура снижается, скорость химической реакции тоже падает. В тот момент, когда температура достигает точки замерзания, фермент инактивируется, но при этом не денатурирует (см. видео).
В наше время для длительного хранения продуктов широко используют способ быстрого замораживания. Оно останавливает рост и развитие микроорганизмов, а также инактивирует ферменты, находящиеся внутри микроорганизмов, и предотвращает разложение продуктов питания.
Кроме этого, активность ферментов зависит ещё от pH среды (кислотности – то есть показателя концентрации ионов водорода).
В большинстве случаев, ферменты работают при нейтральном pH, т. е. при pH около 7. Но существуют ферменты, которые работают либо в кислой и сильнокислой, либо в щелочной и сильнощелочной среде. Например, один из таких ферментов – пепсин, он находится у нас с вами в желудке, работает в сильнокислой среде и расщепляет белки. Поскольку в желудке среда достаточно кислая, 1,5 – 2 pH, то этот фермент работает при сильнокислой среде.
Ферменты подвержены действию активаторов и ингибиторов. Некоторые ионы, например, ионы металлов Mg, Mn, Zn активируют ферменты. Другие же ионы (к ним относятся ионы тяжелых металлов, а именно Hg, Pb, Cd), наоборот, подавляют активность ферментов, денатурируют их белки.
В 1961 году была предложена систематическая классификация ферментов на 6 групп. Но названия ферментов оказались очень длинными и трудными в произношении, поэтому ферменты принято сейчас именовать с помощью рабочих названий. Рабочее название состоит из названия субстрата, на который действует фермент, и окончания «аза» (рис. 5). Например, если вещество — лактоза, то есть молочный сахар, то лактаза – это фермент который его преобразует. Если сахароза (обыкновенный сахар), то фермент, который его расщепляет, – сахараза. Соответственно, ферменты, которые расщепляют протеины, носят название протеиназы.
Ферменты применяются практически во всех областях человеческой деятельности, и такое широкое применение, в первую очередь, связано с тем, что они сохраняют свои уникальные свойства вне живых клеток.
Ферменты групп амилаз, протеаз и липаз применяются в медицине. Они расщепляют крахмал, белки и жиры. Все эти ферменты, как правило, входят в состав комбинированных препаратов, таких как фестал и панзинорм, и используются, в первую очередь, для лечения заболеваний желудочно-кишечного тракта (рис. 6).
Ферменты применяют для растворения тромбов в кровеносных сосудах, при лечении гнойных ран.
Особое место занимает энзимотерапия при лечении онкологических заболеваний.
Такие ферменты как амилаза расщепляют крахмал и поэтому широко используются в пищевой промышленности. В пищевой промышленности используется протеиназа, расщепляющая белки, и липазы, расщепляющие жиры. Ферменты амилазы используются в хлебопечении, виноделии и пивоварении (см. видео).
Протеазы используются для смягчения мяса и при изготовлении готовых каш.
Липазы используются в производстве сыра.
Ферменты широко используются в косметической промышленности, входят в состав кремов, некоторые ферменты входят в состав стиральных порошков.
Ферменты были открыты при изучении процессов брожения. Представления о том, что химические процессы внутри живых организмов протекают под действием каких-то особенных веществ, возникло более 200 лет назад. В XIX века Луи Пастер (рис. 7) доказал, что сбраживание дрожжами сахара в спирт катализируется веществами белковой природы. Пастер ошибочно считал, что ферменты неотделимы от живых клеток. Другой ученый, Эдуард Бухнер, доказал, что в водных экстрактах живых клеток находится набор ферментов, катализирующих превращение сахара в спирт. Именно его открытие дало начало новой науке – энзимологии.
Успехи энзимологии во второй половине XX века привели к тому, что в настоящее время выделено и очищено более 2000 ферментов, которые используются в различных отраслях человеческой деятельности.
Энзимопатология – область энзимологии, которая изучает связь между болезнью и недостаточным синтезом, или отсутствием синтеза какого-либо фермента.
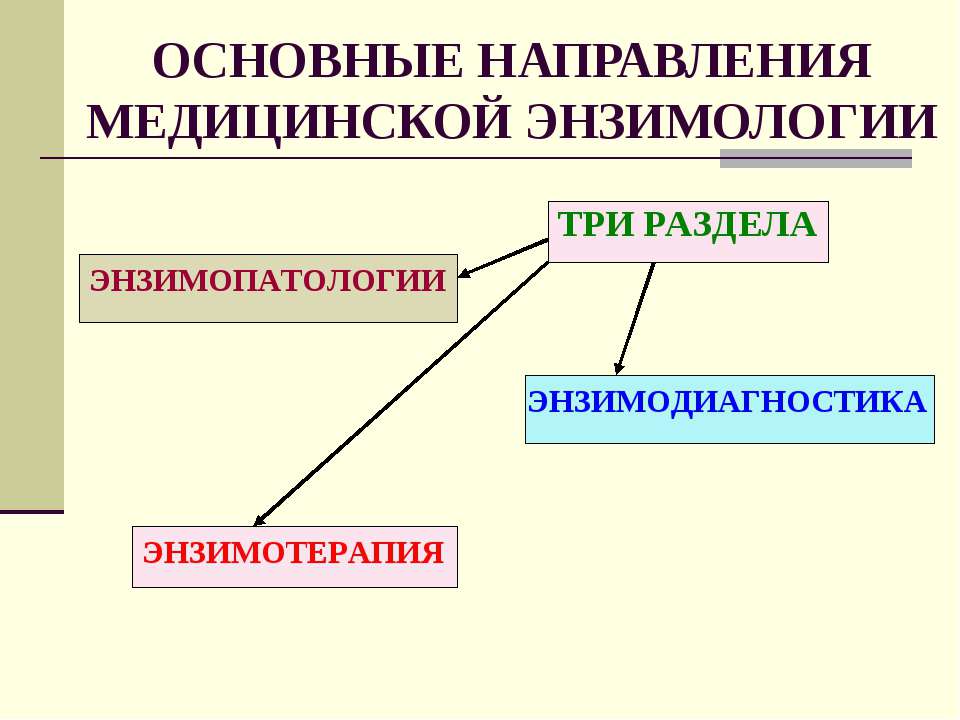
Например, причиной наследственного заболевания – фенилкетонурии, которое сопровождается расстройством психической деятельности, является потеря клетками печени способности синтезировать фермент, катализирующий превращение фенилаланина в тирозин.
В результате в организме накапливаются токсические вещества. Новорожденный ребенок выглядит здоровым, а первые симптомы фенилкетонурии проявляются в возрасте от двух до шести месяцев. Это выраженная вялость, отсутствие интереса к окружающему миру, повышенная раздражительность, а также беспокойство и рвота.
Во втором полугодии жизни у ребенка выражено отставание в психическом развитии. Менее чем в 10% случаев – это слабая степень олигофрении, а у 60% развивается идиотия.
При своевременной диагностике патологических изменений можно избежать, если с момента рождения до наступления полового созревания ограничить поступление фенилаланина с пищей.
На этом уроке мы с вами выяснили, что ферменты используются в различных областях человеческой деятельности.
Они широко используются в пищевой промышленности, в медицине, в косметике и бытовой химии. Например, в стиральные порошки добавляют амилазу, которая расщепляет крахмал, протеазы, расщепляющие белки или белковые загрязнения, и липазы, очищающие ткани от жира и масла. Как правило, в состав стирального порошка входит комбинация этих ферментов, то есть ферментные препараты усиливают действие друг друга.
Сегодня наиболее изученными ферментами являются протеазы и амилазы. Липазы не всегда стабильны по качеству. Их разработкой занимаются только 10 лет, а амилаза и протеаза существуют на рынке уже более полувека. Сегодня эти две категории ферментов очень хорошо изучены и дают прекрасные результаты, чего пока что нельзя сказать о липазах. Липазы полностью справляются с загрязнениями только после двух-трех стирок, а протеазы и амилазы – за одну.
Ученые подсчитали, что добавление ферментов в стиральные порошки на 30-35% увеличивает моющую способность данного порошка.
источник конспекта - http://interneturok.ru/ru/school/biology/10-klass/bosnovy-citologii-b/fermenty-biologicheskie-katalizatory-znachenie-fermentov
источник видео - http://www.youtube.com/watch?v=tXYpopga1dI
источник видео - http://www.youtube.com/watch?v=Tw0YmuSfbgE
источник видео - http://www.youtube.com/watch?v=IWxA_PyZNIY
источник видео - http://www.youtube.com/watch?v=tCg-CRpQbE4
источник видео - http://www.youtube.com/watch?v=jeZtXRmu4KA
источник видео - http://www.youtube.com/watch?v=uWuoiX7qiqA
источник видео - http://www.youtube.com/watch?v=YKpFmw8UWUM
источник презентации - https://prezentacii.org/prezentacii/prezentacii-po-biologii/16789-biologicheskie-katalizatory.html
