СТРОЕНИЕ АТОМА И АТОМНОГО ЯДРА. ИСПОЛЬЗОВАНИЕ ЭНЕРГИИ АТОМНЫХ ЯДЕР. IV четверть. 9 класс. Физика.
СТРОЕНИЕ АТОМА И АТОМНОГО ЯДРА. ИСПОЛЬЗОВАНИЕ ЭНЕРГИИ АТОМНЫХ ЯДЕР. IV четверть. 9 класс. Физика.
Комментарии преподавателя
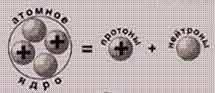
СОСТАВ АТОМНОГО ЯДРА

Ядро атома состоит из нуклонов, которые подразделяются на протоны и нейтроны.
Символическое обозначение ядра атома:
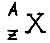
А- число нуклонов, т.е. протонов + нейтронов ( или атомная масса )
Z- число протонов ( равно числу электронов )
N- число нейтронов ( или атомный номер )
N = A - Z
Открытие нейтрона дало толчок к пониманию того, как устроены ядра атомов.
В том же 1932 г., когда был открыт нейтрон, советский физик Дмитрий Дмитриевич Иваненко и немецкий физик Вернер Гейзенберг предложили протонно-нейтронную модель строения ядер, справедливость которой была впоследствии подтверждена экспериментально.
Протоны и нейтроны называются нуклонами (от лат. nucleus — ядро). Используя этот термин, можно сказать, что атомные ядра состоят из нуклонов.
- Общее число нуклонов в ядре называется массовым числом и обозначается буквой А
Так, например, для азота  массовое число А = 14, для железа
массовое число А = 14, для железа  A = 56, для урана
A = 56, для урана  A = 235.
A = 235.
Понятно, что массовое число А численно равно массе ядра m, выраженной в атомных единицах массы и округлённой до целых чисел (поскольку масса каждого нуклона примерно равна 1 а. е. м.). Например, для азота m ≈ 14 а. е. м., для железа m ≈ 56 а. е. м. и т. д.
- Число протонов в ядре называется зарядовым числом и обозначается Z
Например, для азота  зарядовое число Z = 7, для железа
зарядовое число Z = 7, для железа 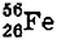 Z = 26, для урана
Z = 26, для урана  Z = 92 и т. д.
Z = 92 и т. д.
Заряд каждого протона равен элементарному электрическому заряду. Поэтому зарядовое число Z численно равно заряду ядра, выраженному в элементарных электрических зарядах. Для каждого химического элемента зарядовое число равно атомному (порядковому) номеру в таблице Д. И. Менделеева.
Ядро любого химического элемента в общем виде обозначается так:  (под X подразумевается символ химического элемента).
(под X подразумевается символ химического элемента).
Число нейтронов в ядре обычно обозначают буквой N. Поскольку массовое число А представляет собой общее число протонов и нейтронов в ядре, то можно записать: А = Z + N.
На основе протонно-нейтронной модели строения атомных ядер было дано объяснение некоторым экспериментальным фактам, открытым в первые два десятилетия XX в.
Так, в ходе изучения свойств радиоактивных элементов было обнаружено, что у одного и того же химического элемента встречаются атомы с различными по массе ядрами.
Одинаковый заряд ядер свидетельствует о том, что они имеют один и тот же порядковый номер в таблице Д. И. Менделеева, т. е. занимают в таблице одну и ту же клетку, одно и то же место. Отсюда и произошло название всех разновидностей одного химического элемента: изотопы (от греч. слов isos — одинаковый и topos — место).
- Изотопы — это разновидности данного химического элемента, различающиеся по массе атомных ядер
Благодаря созданию протонно-нейтронной модели ядра (т. е. примерно через два десятилетия после открытия изотопов), удалось объяснить, почему атомные ядра с одним и тем же зарядом обладают разными массами. Очевидно, ядра изотопов содержат одинаковое число протонов, но различное число нейтронов.
Так, например, существует три изотопа водорода:  (протий),
(протий),  . (дейтерий) и
. (дейтерий) и 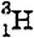 (тритий). Ядро изотопа
(тритий). Ядро изотопа  вообще не имеет нейтронов — оно представляет собой один протон. В состав ядра дейтерия
вообще не имеет нейтронов — оно представляет собой один протон. В состав ядра дейтерия  входят две частицы: протон и нейтрон. Ядро трития
входят две частицы: протон и нейтрон. Ядро трития 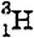 состоит из трёх частиц: одного протона и двух нейтронов.
состоит из трёх частиц: одного протона и двух нейтронов.
Гипотеза о том, что атомные ядра состоят из протонов и нейтронов, подтверждалась многими экспериментальными фактами.
Но возникал вопрос: почему ядра не распадаются на отдельные нуклоны под действием сил электростатического отталкивания между положительно заряженными протонами?
Расчёты показывают, что нуклоны не могут удерживаться вместе за счёт сил притяжения гравитационной или магнитной природы, поскольку эти силы существенно меньше электростатических .
В поисках ответа на вопрос об устойчивости атомных ядер учёные предположили, что между всеми нуклонами в ядрах действуют какие-то особые силы притяжения, которые значительно превосходят электростатические силы отталкивания между протонами. Эти силы назвали ядерными.
Гипотеза о существовании ядерных сил оказалась правильной. Выяснилось также, что ядерные силы являются короткодействующими: на расстоянии 10-15 м они примерно в 100 раз больше сил электростатического взаимодействия, но уже на расстоянии 10-14 м они оказываются ничтожно малыми. Другими словами, ядерные силы действуют на расстояниях, сравнимых с размерами самих ядер.
Домашняя работа
1. Ответь на вопросы.
- Как называются протоны и нейтроны вместе?
- Что называется массовым числом? Что можно сказать о числовом значении массы атома (в а. е. м.) и его массовом числе?
- Что можно сказать о зарядовом числе, заряде ядра (выраженном в элементарных электрических зарядах) и порядковом номере в таблице Д. И. Менделеева для любого химического элемента?
- Как связаны между собой массовое число, зарядовое число и число нейтронов в ядре?
- Как в рамках протонно-нейтронной модели ядра объяснить существование ядер с одинаковыми зарядами и различными массами?
- Какой вопрос возникал в связи с гипотезой о том, что ядра атомов состоят из протонов и нейтронов? Какое предположение пришлось сделать учёным для ответа на этот вопрос?
- Как называются силы притяжения между нуклонами в ядре и каковы их характерные особенности?
2. Реши ребус.


К занятию прикреплены файлы «Это интересно!» и «Тест». Вы можете скачать файлы в любое удобное для вас время.
Использованные источники:
- http://class-fizika.narod.ru/9_37.htm
- http://interneturok.ru/ru/school/physics/9-klass/
- http://www.tepka.ru/fizika_9/56.html
- https://www.youtube.com/watch?v=5WxyWtwfwhE
- https://www.youtube.com/watch?v=o_6lA6MM4Lc
- https://www.youtube.com/watch?v=netv8LixuY0
