9 класс. Химия. Свойства элемента и простого вещества азота
9 класс. Химия. Свойства элемента и простого вещества азота
Комментарии преподавателя
Строение и свойства атомов. Элемент азот N — первый представитель главной подгруппы V группы Периодической системы. Его атомы содержат на внешнем энергетическом уровне пять электронов, из которых три электрона неспаренные (вспомните правило «8-N»). Отсюда следует, что атомы этих элементов могут присоединять три электрона, завершая внешний энергетический уровень, и вследствие этого приобретают степень окисления -3, например в соединениях с водородом — аммиаке NН3 и с металлами — нитридах Li3N, Mg3N2 и др.
Атомы азота могут также отдавать свои внешние электроны более электроотрицательным элементам (фтору, кислороду) и приобретать при этом степени окисления +3 и +5. Атомы азота проявляют восстановительные свойства и в степенях окисления +1, +2, +4.
Азот — простое вещество. В свободном состоянии азот существует в виде двухатомной молекулы М2. В этой молекуле два атома N связаны очень прочной тройной ковалентной связью:

Эту связь можно обозначить и так:
N=N
Азот — бесцветный газ без запаха и вкуса. В воде растворяется хуже кислорода. Прочностью молекулы азота обусловлена его химическая инертность.
При обычных условиях азот взаимодействует только с литием, образуя нитрид Li3N:
6Li + N2 = 2Li3N
С другими металлами он взаимодействует только при высоких температурах.
Также при высоких температурах и давлении в присутствии катализатора азот реагирует с водородом, образуя аммиак:
2N+ ЗН2 <-> 2NH3
(дайте характеристику этой реакции и рассмотрите условия смещения химического равновесия вправо).
При температуре электрической дуги он соединяется с кислородом, образуя оксид азота(II) (дайте характеристику этой реакции и также рассмотрите условия смещения химического равновесия вправо).
В природе азот содержится в основном в атмосфере — 78,09% по объему или 65,6% по массе. Над каждым гектаром земной поверхности постоянно «висят» 8 тыс. т азота. Из природных неорганических соединений азота наиболее известна чилийская селитра NaNO3.
Большая часть связанного азота содержится в органических веществах.
Азот, полученный перегонкой жидкого воздуха, в промышленности применяют для синтеза аммиака и производства азотной кислоты. Раньше этот газ в качестве инертной среды использовали для наполнения электрических ламп. В медицине чистый азот применяется в качестве инертной среды при лечении туберкулеза легких, а жидкий азот — при лечении заболеваний позвоночника, суставов и др.
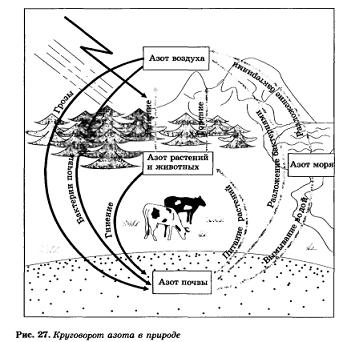
Круговорот азота в природе. Азот — жизненно важный элемент. Все основные части клеток тканей организма построены из белковых молекул, в состав которых входит азот. Без белка нет жизни, а без азота нет белка. Человек получает белки из растительной и животной пищи, животные, в свою очередь, получают их также из растений. Следовательно, растения — один из источников пополнения азота, который поддерживает жизнь.
Содержание связанного азота в почве очень незначительно (до 1 кг в 1 т), к тому же большая часть его входит в состав органических соединений и непосредственно недоступна для растений. Однако постепенно, в результате деятельности бактерий, органические соединения превращаются в минеральные — соли аммония или нитраты, которые и усваиваются растениями.
Азот входит в состав растительных белков. Животные получают готовые белковые вещества из растений; в животном организме содержится от 1 до 10% азота (по массе), в шерсти и в рогах — около 15%. Все важнейшие части клеток (цитоплазма, ядро, оболочка) построены из белковых молекул.
Еще большее значение имеют особые бактерии, которые живут в клубеньках на корнях бобовых растений (клевера, гороха, вики, люпина и др.), их так и называют «клубеньковыми». Вот эти бактерии и связывают свободный атмосферный азот, т. е. превращают его в соединения, которые усваивают растения, образуя белки своего организма.
Соединения азота в почве пополняются также во время грозовых ливней. Как вы уже знаете, при этом из азота и кислорода образуется оксид азота(П), который под действием кислорода воздуха превращается в оксид азота(IV):
2NO + 02 = 2NO2
Последний взаимодействует с водой (также в присутствии кислорода воздуха), и получается азотная кислота:
4NO2 + 02 + 2Н20 = 4НNO3
Эта кислота, попадая в почву, реагирует с находящимися в ней соединениями натрия, кальция, калия и образует соли — селитры, необходимые для растений (рис. 27).
Открытие азота. В 1772 г. английский ученый Д. Резерфорд и шведский исследователь К. Шееле обнаружили в своих экспериментах по сжиганию веществ газ, который не поддерживает дыхания и горения. Позднее, в 1787 г., А. Лавуазье установил наличие в воздухе газа, не поддерживающего дыхания и горения, и по его предложению этому газу было дано название «азот», означающее «безжизненный» (от лат. а — нет и зоэ — жизнь). Другое латинское название нитрогениум, введенное в 1790 г. Ж. Шапталем, означает «рождающий селитру».
1. Строение атомов и молекул азота.
2. Свойства азота: взаимодействие с металлами, водородом, кислородом.
3. Получение азота из жидкого воздуха.
4. Применение азота.
5. Азот в природе и его биологическое значение.
Напишите уравнения реакций взаимодействия азота с магнием, кальцием, алюминием. Рассмотрите эти окислительно-восстановительные процессы. Как называются продукты реакций? Каков вид химической связи в них и тип кристаллической решетки? Какими свойствами должны обладать продукты реакций?
Напишите уравнения реакций, с помощью которых можно осуществить следующие переходы:
N2 -> Li3N -> NH3 -> N0 -> N02 -> НNO3
Рассмотрите первую реакцию как окислительно-восстановительную.
Дайте характеристику реакции по различным признакам:
2NO + 02 <-> 2NO2 + Q
Рассмотрите условия смещения химического равновесия вправо.
Определите коэффициенты в уравнениях реакций, соответствующих следующим схемам, методом электронного баланса:
а) NH3 + 02 -> N0 + Н20
б) МН3 + 02 -> N2 + Н20
В лаборатории азот получают разложением нитрита аммония:
NH4N02 -> N2 + 2Н20
Придумайте и решите задачу, в условии которой была бы указана масса исходного вещества и массовая доля в нем примесей, а требовалось бы найти объем одного продукта и число молекул другого получаемого вещества.
источники
https://www.youtube.com/watch?v=eBFLr7ThPiA
http://school.xvatit.com/index.php?title
источник презентации - http://ppt4web.ru/khimija/kharakteristika-azota-kak-khimicheskogo-ehlementa-i-prostogo-veshhestva.html
