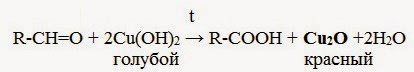10 класс. Химия. Химические свойства альдегидов и кетонов
10 класс. Химия. Химические свойства альдегидов и кетонов
Комментарии преподавателя
|
Получение альдегидов I. В промышленности
Этот способ более перспективен, чем гидратация алкинов, при которой используются токсичные ртутные катализаторы. В промышлености альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn).
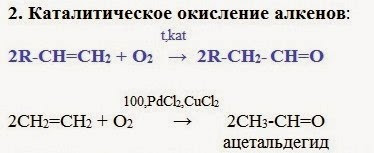
Этот способ позволяет получать карбонильные соединения, в особенности альдегиды, без побочных продуктов окисления. II. В лаборатории 1. Гидратация алкинов (раньше использовали в промышленности – способ дорогой) - присоединение: Присоединение воды к ацетилену в присутствии солей ртути (II) приводит к образованию ацетальдегида:Кетоны получают при гидратации других гомологов ряда алкинов: 2. Окисление спиртов: Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (tкип альдегида, не образующего межмолекулярные водородные связи, нижеtкип спирта и кислоты). При окислении вторичных спиртов образуются кетоны.
Химические свойства альдегидов Для карбонильных соединений характерны реакции различных типов: · присоединение по карбонильной группе; · полимеризация; · конденсация; · восстановление и окисление. Большинство реакций альдегидов и кетонов протекает по механизму нуклеофильного присоединения (AN) по связи С=О. Это объясняется, главным образом, двумя факторами: · углеводородные радикалы у группы С=О увеличивают пространственные препятствия присоединению к карбонильному атому углерода новых атомов или атомных групп; · углеводородные радикалы за счет +I-эффекта уменьшают положительный заряд на карбонильном атоме углерода, что затрудняет присоединение нуклеофильного реагента. I. Реакции присоединения 1. Присоединение водорода (восстановление): R-CH=O + H2 t,Ni → R-CH2-OH (первичный спирт)
2. Присоединение циановодородной кислоты (синильной):
Эта реакция используется для удлинения углеродной цепи, а также для получения α-гидроксикислот R-CH(COOH)OH по схеме: R-CH(CN)OH + H2O -> R-CH(COOH)OH + NH3 CH3-CH=O + H-CN → CH3-CH(CN)-OH CH3-CH(CN)-OH циангидрин –яд! в ядрах косточек вишен, слив 3. Со спиртами – получают полуацетали и ацетали: Полуацетали - соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Ацетали - соединения, в которых атом углерода связан с двумя алкоксильными (-OR) группами. 4. Присоединение воды: 5. Присоединение реактива Гриньяра (используется для получения первичных спиртов, кроме метанола):
Здесь R – алкильный или арильный радикал; Х – это галоген. HCH=O + CH3-Mg-Cl → CH3-CH2-O-Mg-Cl (присоединение) CH3-CH2-O-Mg-Cl + H2O → CH3-CH2-OH + Mg(OH)Cl (гидролиз) II. Реакции окисления 1. Реакция серебряного зеркала – качественная реакция на альдегидную группу: 2. Окисление гидроксидом меди(II):
3. Альдегиды могут быть окислены до кислот бромной водой III. Реакции замещения С галогенами: CH3-CH=O + Cl2 → ClCH2-CH=O + HCl здесь , ClCH2-CH=O - хлоруксусный альдегид n CH2=O t,kat → ( -CH2-O-)n полиформальдегид n H-CH=O + (n+1) C6H5-OH t,kat→ nH2O + [-C6H3(OH)-CH2-C6H3(OH)-]n фенолформальдегидная смола Применение Метаналь (муравьиный альдегид) CH2=O
Этаналь (уксусный альдегид, ацетальдегид) СН3СН=О
ЦОР: Применение уксусного альдегида ТРЕНАЖЁРЫ: Получение альдегидов и кетонов Тестовые задания по теме "Альдегиды" Химические свойства альдегидов ВИДЕО: Качественная реакция на альдегиды с фуксинсернистой кислотой Качественная реакция на альдегиды с гидроксидом меди (II) Задания для самостоятельной работы: |
Источники
конспект - https://sites.google.com/site/himulacom/zvonok-na-urok/10-klass---tretij-god-obucenia/urok-no35-svojstva-aldegidov-polucenie-i-primenenie
http://www.youtube.com/watch?v=Nipbnb1YaAI
http://www.youtube.com/watch?v=gBn_B_-qC4k
http://www.youtube.com/watch?t=3&v=O8sbBNPE0HA
http://www.youtube.com/watch?t=2&v=26xGAV4LRIA
http://www.youtube.com/watch?v=Bwbw0yDT4Ig
Файлы
Нет дополнительных материалов для этого занятия.